Objetivos
Ao final da leitura deste capítulo, o leitor será capaz de
- definir a epidemiologia e a fisiopatologia da encefalopatia bilirrubínica aguda (EBA) e da encefalopatia secundária à hipoglicemia;
- classificar a encefalopatia bilirrubínica no recém-nascido (RN);
- reconhecer as manifestações clínicas da EBA no RN com 35 semanas de idade gestacional (IG) ou mais e naqueles com 34 semanas de IG ou menos;
- reconhecer o escore de disfunção neurológica induzida por bilirrubina (do inglês, bilirubin-induced neurologic dysfunction [BIND]);
- identificar as sequelas da EBA;
- manejar a EBA;
- estabelecer estratégias preventivas para a hiperbilirrubinemia no RN;
- reconhecer as dificuldades na definição da hipoglicemia;
- identificar as alterações no neurodesenvolvimento secundárias à hipoglicemia;
- identificar os RNs de risco para hipoglicemia;
- avaliar riscos e benefícios do tratamento da hipoglicemia.
Esquema conceitual

Introdução
A icterícia neonatal, expressão clínica da hiperbilirrubinemia, é uma das manifestações clínicas mais frequentes no período neonatal. A hiperbilirrubinemia indireta neonatal, na maioria das vezes, reflete uma condição clínica benigna e fisiológica, embora, em alguns casos, ocorra elevação anormal da bilirrubina total (BT) nas primeiras semanas de vida, com risco de danos ao sistema nervoso central (SNC). 1
A maior preocupação dos profissionais de saúde é o desenvolvimento da EBA, que, ao exame anatomopatológico, caracteriza-se por coloração amarelada dos gânglios da base, denominada kernicterus. Apesar de rara, a EBA é uma causa importante de paralisia cerebral e sequela neurológica em sobreviventes, assim como causa de mortalidade neonatal nas primeiras semanas de vida, sendo considerada um grave problema de saúde pública, principalmente em países de média e baixa renda.1
É importante destacar que a falta de reconhecimento das causas de hiperbilirrubinemia neonatal patológica atrasa seu diagnóstico e a intervenção necessária para evitar níveis potencialmente graves de bilirrubinemia, prevenindo a evolução para EBA. Se houver falha na prevenção de níveis críticos de BT no RN, a detecção de quadros iniciais de EBA e a intervenção terapêutica adequada podem evitar o dano permanente ao SNC.2
Já a hipoglicemia, é o distúrbio metabólico mais frequente no período neonatal e pode levar a sequelas neurológicas em longo prazo. De acordo com as recomendações atuais, cerca de 30% dos RNs são considerados de risco para hipoglicemia. Destes, 15% recebem diagnóstico de hipoglicemia e, aproximadamente, 10% necessitam de internação em unidade de terapia intensiva neonatal (UTIN), custando cerca de US$ 2,1 bilhões por ano nos Estados Unidos.3
A hipoglicemia neonatal, no entanto, frequentemente, é assintomática ou associada com sintomas inespecíficos, e o limiar glicêmico preciso para o desenvolvimento de lesões cerebrais não está claramente estabelecido. Os programas de triagem disponíveis até o momento exibem problemas substanciais, incluindo o tratamento excessivo da redução fisiológica glicêmica após o nascimento, interferência com aleitamento materno e coleta excessiva de sangue nos bebês com risco para hipoglicemia.
Algumas condições estão associadas a alterações neurológicas em longo prazo secundárias à hipoglicemia neonatal. Entre elas, estão glicemia plasmática menor que 18mg/dL (se transitória, não existem estudos na literatura confirmando sequelas em longo prazo), baixo valor de glicemia por períodos prolongados (não existe estudo que defina esse período), sinais clínicos mais graves e prolongados (coma, convulsões, depressão respiratória, apneia, hipotonia) e episódios repetidos de hipoglicemia associados com hiperinsulinismo.
Encefalopatia bilirrubínica no recém-nascido
Definição e classificação

A encefalopatia bilirrubínica é uma manifestação clínica que atinge o SNC desencadeada por níveis plasmáticos tóxicos de bilirrubina indireta livre. Essa patologia pode ser uma manifestação transitória, na fase inicial da EBA, ou causar dano permanente com sequelas irreversíveis.1,2,4
Nos estágios iniciais do período neonatal, as manifestações agudas da neurotoxicidade da bilirrubina são definidas como EBA, e as sequelas permanentes e crônicas são conhecidas como kernicterus. Nem todos os casos de EBA progridem para kernicterus e nem todos os pacientes com encefalopatia bilirrubínica crônica têm uma história anterior de encefalopatia bilirrubínica clássica, principalmente os prematuros. Nesse grupo de RN, muitas vezes, a identificação é retrospectiva, com avaliação de exames de imagem e triagem auditiva.2,4
Epidemiologia
Apesar de a EBA ser uma doença evitável e tratável, infelizmente, ainda é uma condição clínica relatada em todo o mundo, e sua incidência é inversamente proporcional ao desenvolvimento econômico do país.5
Em estudo com revisão sistemática para detectar a incidência da hiperbilirrubinemia grave, observaram-se, em média, 99 casos por 100 mil nascidos vivos (NVs), com variação de 37 casos por 100 mil NVs na Europa a 6.678 casos por 100 mil NVs na África.5 Em países desenvolvidos, ocorre 1 caso de kernicterus para cada 40 mil a 150 mil NVs, sendo muito mais elevada a incidência de encefalopatia bilirrubínica em países de baixa e média renda.1,2,4,5
Um estudo recente da UTIN da Universidade do Cairo mostrou que 7% das admissões com icterícia neonatal apresentaram EBA moderada a grave (n = 47/674), com nível médio de BT de 33mg/dL e taxa de letalidade de 21%. Além disso, o kernicterus demonstrou ser uma causa significativa de paralisia cerebral em algumas áreas do Egito.2

As principais causas associadas à encefalopatia bilirrubínica são as doenças hemolíticas por incompatibilidade Rh e ABO; entretanto, nas últimas décadas, surgiram relatos de casos em RNs maiores que 35 semanas de IG em aleitamento materno exclusivo e que receberam alta hospitalar antes de 48 horas de vida sem acompanhamento adequado, contribuindo, assim, para readmissões em leitos de hospitais pediátricos, com elevados custos no âmbito da saúde pública.1,5
Segundo dados do Ministério da Saúde (MS), 3.086 óbitos infantis ocorreram no Brasil nos últimos 15 anos, e sua causa básica foi registrada como icterícia, hemólise ou kernicteurs,6 ressaltando-se que para cada RN que vai a óbito, vários sobrevivem com deficiência auditiva e sequelas neurológicas irreversíveis, tornando-se um ônus para os genitores e o Estado.
Em RNs prematuros, a encefalopatia bilirrubínica crônica e/ou kernicterus pode ocorrer com níveis baixos de bilirrubina sérica e as manifestações clínicas são sutis, o que dificulta o diagnóstico. Um estudo recente no Japão com prematuros de IG inferior a 30 semanas mostrou incidência de kernicterus de 1,8 cada 1.000 NVs com diagnóstico retrospectivo realizado por meio de ressonância magnética (RM) ou triagem auditiva.7,8
Fisiopatologia
A deposição de bilirrubina indireta e não conjugada nas células cerebrais é o principal processo fisiopatológico da manifestação clínica da encefalopatia bilirrubínica. Algumas áreas do cérebro são mais vulneráveis à impregnação da bilirrubina, como globo pálido, gânglios da base, substância negra, hipocampo e núcleos talâmicos, com um padrão simétrico de envolvimento.2
Sabe-se que, quanto maior o tempo de exposição do tecido cerebral à bilirrubina, maior será a área afetada. Os nervos cranianos, principalmente o terceiro, o quarto e o sexto, também estão envolvidos na encefalopatia bilirrubínica, assim como os núcleos cocleares e os sistemas oculomotor e vestibular.2
Na patologia celular, são detectados comprometimento do sistema de transporte de glicose, síntese de DNA, proteínas, neurotransmissores, transporte de ferro e apoptose celular. A degeneração das mitocôndrias e as alterações da membrana das células cerebrais causam alterações irreversíveis e permanentes, que levam à encefalopatia bilirrubínica crônica e/ou kernicterus.2,9,10
A Figura 1 mostra corte do encéfalo de RN com kernicterus fatal por deficiência de glicose-6-fosfato desidrogenase (G6PD).

1: hipocampo; 2: gânglios basais; 3: substância negra; 4: tálamo. FIGURA 1: Corte do encéfalo de RN com kernicterus fatal por deficiência de G6PD. // Fonte: Zangen e colaboradores (2009).10
Manifestações clínicas da encefalopatia bilirrubínica aguda em recém-nascido com 35 semanas ou mais de idade gestacional
As manifestações clínicas secundárias à neurotoxicidade induzida pela bilirrubina são evidenciadas nos primeiros dias até as primeiras semanas de vida. Inicialmente, elas são inespecíficas e bastante variáveis, e a progressão clínica depende do aumento dos níveis séricos de bilirrubina, do tempo de exposição da bilirrubina ao tecido cerebral, da suscetibilidade individual, da IG e da presença de comorbidades, como imaturidade da barreira hematoencefálica pela prematuridade e condições clínicas agravantes, como sepse neonatal, hipoalbuminemia, acidose metabólica e/ou hipóxia perinatal.2,4,8

Sinais neurológicos definitivos de EBA são observados em 55 a 60% dos pacientes. Outros casos podem não ter sintomas definitivos ou ter sinais neurológicos sutis.2
Nos RNs com 35 semanas ou mais de IG, a EBA é caracterizada por alterações progressivas no estado mental, no comportamento e no tônus muscular, sendo dividida em três fases — inicial, intermediária e avançada (Quadro 1).
Quadro 1
|
EVOLUÇÃO POR FASE CLÍNICA DA ENCEFALOPATIA BILIRRUBÍNICA AGUDA EM RECÉM-NASCIDOS COM 35 SEMANAS OU MAIS DE IDADE GESTACIONAL |
|||
|
Fase clínica |
Inicial (3 a 5 dias de doença) |
Intermediária |
Avançada |
|
Estado mental |
|
|
|
|
Tônus muscular |
|
|
|
|
Choro |
|
|
|
// Fonte: Adaptado de American Academy of Pediatrics (2004).11

Na fase inicial da encefalopatia bilirrubínica, o RN desenvolve sintomas inespecíficos, como letargia, hipotonia e debilidade de sucção, progredindo, em 3 a 5 dias, para a fase intermediária. Essa fase se caracteriza por estupor, irritabilidade, hipertermia, choro intenso, hipertonia, opistótono (arqueamento do tronco) e/ou retrocolo (arqueamento cervical). Se não tratada em tempo hábil, evolui para a fase avançada e/ou óbito.2,4
Na fase avançada, o dano cerebral é irreversível na maioria dos casos e observam-se choro constante, febre, estupor ou coma; convulsões podem estar presentes, com agravamento do opistótono. Nesse estágio, em países desenvolvidos, a mortalidade chega a 10% por insuficiência respiratória ou convulsões recorrentes. Nos sobreviventes, vale ressaltar que anormalidades auditivas e visuais, atetose e convulsão (em alguns casos) foram observadas após a primeira semana de vida.2,4
A Figura 2 mostra um RN em opistótono com EBA com hiperbilirrubinemia extrema.
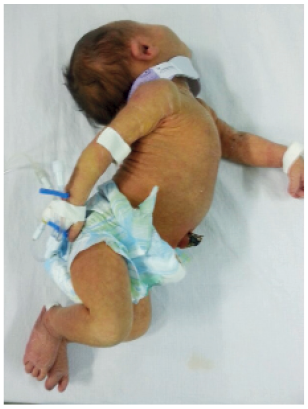
FIGURA 2: RN em opistótono com EBA com hiperbilirrubinemia extrema (BT = 32mg/dL). Recebeu alta precoce e desenvolveu doença hemolítica ABO. // Fonte: Arquivo de imagem das autoras.

Além das manifestações clínicas, alguns exames podem auxiliar no diagnóstico da encefalopatia bilirrubínica. A RM do cérebro é a melhor modalidade de imagem para confirmação do diagnóstico. Na fase aguda da encefalopatia, os achados de edema cerebral bilateral generalizado são encontrados e, na fase crônica, são visualizadas hipercondensações simétricas em regiões específicas do cérebro, principalmente no globo pálido e nos núcleos subtalâmicos (Figuras 3A–D).12

FIGURA 3: RM de criança de 3 anos com kernicterus por doença hemolítica RH. A) Hipersinal simétrico bilateral nos núcleos subtalâmicos (setas), sem efeito de massa. B) Sinal hiperecoico simétrico bilateral no globo pálido (setas). C e D) Sem evidências de alterações. // Fonte: Ribeiro e colaboradores (2016).12
O potencial evocado auditivo do tronco encefálico (PEATE) pode auxiliar na identificação da lesão neuronal. Um resultado anormal sugere fortemente disfunção auditiva neuronal. Esse exame detecta possíveis alterações da integridade de vias auditivas do tronco encefálico por meio da sua atividade eletrofisiológica, detectando as perdas neurossensoriais.2
Quando os exames de imagem não estão disponíveis, existe a ferramenta clínica denominada escore de BIND, que possibilita aos médicos diagnosticarem e estimarem a gravidade da EBA. É um sistema de pontuação simples que avalia o estado mental, o tônus muscular e o choro do RN. Cada categoria é classificada de 1 a 3, com um número mais alto atribuído para os achados mais graves e patológicos.13,14
A soma das três categorias do escore de BIND produz uma pontuação final, variando de 0 a 9. Uma pontuação de 1 a 3 significa EBA leve e reversível; de 4 a 6, EBA moderada, que pode reverter com intervenção oportuna; e 7 a 9 indica EBA grave com prognóstico ruim (Quadro 2).13,14
Quadro 2
|
ESCORE DE DISFUNÇÃO NEUROLÓGICA DA BILIRRUBINA — BIND |
||||
|
Gravidade |
Escore |
Estado mental |
Tônus muscular |
Tipo de choro |
|
Nenhum |
0 |
|
|
|
|
Leve |
1 |
|
|
|
|
Moderado |
2 |
|
|
|
|
Grave |
3 |
|
|
|
// Fonte: Adaptado de Hameed e Hussein (2021);13 Johnson e colaboradores (2009).14
Vale ressaltar que um componente silencioso da encefalopatia bilirrubínica é a neuropatia auditiva, que pode passar despercebida, pois o escore de BIND não inclui avaliação auditiva.

ATIVIDADES
1. Sobre as causas mais comuns de hiperbilirrubinemia que podem resultar em encefalopatia bilirrubínica, assinale a alternativa correta.
A) Doenças hemolíticas por incompatibilidade Rh e ABO.
B) Atresia de vias biliares.
C) Icterícia fisiológica.
D) Clampeamento tardio de cordão.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "A".
As principais causas associadas à encefalopatia bilirrubínica são as doenças hemolíticas por incompatibilidade Rh e ABO e, nas últimas décadas, tem sido descrita encefalopatia bilirrubínica em prematuros tardios com dificuldade no aleitamento e que recebem alta hospitalar precoce.
Resposta correta.
As principais causas associadas à encefalopatia bilirrubínica são as doenças hemolíticas por incompatibilidade Rh e ABO e, nas últimas décadas, tem sido descrita encefalopatia bilirrubínica em prematuros tardios com dificuldade no aleitamento e que recebem alta hospitalar precoce.
A alternativa correta e a "A".
As principais causas associadas à encefalopatia bilirrubínica são as doenças hemolíticas por incompatibilidade Rh e ABO e, nas últimas décadas, tem sido descrita encefalopatia bilirrubínica em prematuros tardios com dificuldade no aleitamento e que recebem alta hospitalar precoce.
2. Observe as afirmativas sobre a encefalopatia bilirrubínica.
I. As sequelas permanentes e crônicas são conhecidas como kernicterus.
II. Todos os casos de EBA progridem para kernicterus.
III. Na fase inicial da EBA, pode ser uma manifestação transitória ou causar dano permanente com sequelas irreversíveis.
IV. Apesar de rara, a EBA é uma causa importante de paralisia cerebral e sequela neurológica em sobreviventes.
Quais estão corretas?
A) Apenas a I e a II.
B) Apenas a I, a III e a IV.
C) Apenas a II, a III e a IV.
D) Apenas a III e a IV.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "B".
Nem todos os casos de EBA progridem para kernicterus e nem todos os pacientes com encefalopatia bilirrubínica crônica têm uma história anterior de encefalopatia bilirrubínica clássica, principalmente os prematuros. Nesse grupo de RNs, muitas vezes, a identificação é retrospectiva, com avaliação de exames de imagem e triagem auditiva.
Resposta correta.
Nem todos os casos de EBA progridem para kernicterus e nem todos os pacientes com encefalopatia bilirrubínica crônica têm uma história anterior de encefalopatia bilirrubínica clássica, principalmente os prematuros. Nesse grupo de RNs, muitas vezes, a identificação é retrospectiva, com avaliação de exames de imagem e triagem auditiva.
A alternativa correta e a "B".
Nem todos os casos de EBA progridem para kernicterus e nem todos os pacientes com encefalopatia bilirrubínica crônica têm uma história anterior de encefalopatia bilirrubínica clássica, principalmente os prematuros. Nesse grupo de RNs, muitas vezes, a identificação é retrospectiva, com avaliação de exames de imagem e triagem auditiva.
3. Sobre a porcentagem de pacientes em que os sinais neurológicos definitivos de EBA são observados, assinale a alternativa correta.
A) Em até 80% dos pacientes.
B) Em menos de 45% dos pacientes.
C) Em 35 a 50% dos pacientes.
D) Em 55 a 60% dos pacientes.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "D".
Os sinais neurológicos definitivos de EBA são observados em 55 a 60% dos pacientes.
Resposta correta.
Os sinais neurológicos definitivos de EBA são observados em 55 a 60% dos pacientes.
A alternativa correta e a "D".
Os sinais neurológicos definitivos de EBA são observados em 55 a 60% dos pacientes.
Encefalopatia bilirrubínica crônica (kernicterus)
Após a EBA, nos RNs sobreviventes, há melhora aparente até que sintomas da encefalopatia crônica apareçam na criança no decorrer dos meses subsequentes. O termo kernicterus tem sido utilizado para associar as manifestações clínicas encontradas na encefalopatia bilirrubínica crônica junto com as evidências das lesões neuropatológicas. O significado do termo kernicterus reflete a impregnação da bilirrubina (icterus) em região dos núcleos da base (kern), especialmente o globo pálido e os núcleos subtalâmicos.2,4,15

No primeiro ano de vida da criança, estão presentes hipotonia, hiper-reflexia, atraso da habilidade motora, reflexo tônico cervical persistente e retardo dos marcos do neurodesenvolvimento. Movimentos extrapiramidais surgem após alguns anos. Durante o final da primeira infância, uma tétrade de sintomas aparece, como visuais (paralisia do olhar para cima), auditivos (perda auditiva neurossensorial), displasia dentária e distúrbios extrapiramidais (paralisia cerebral, coreoatetose). O intelecto, em geral, é relativamente poupado.2,15
Disfunção oculomotora
O kernicterus facial inclui a retração da pálpebra e o sinal do sol poente (ou seja, paralisa do olhar para cima) e pode persistir por, pelo menos, 2 a 3 semanas após a EBA.2,15
Disfunção auditiva
A perda auditiva neurossensorial pode ser o único sintoma da encefalopatia induzida pela bilirrubina. O transtorno do espectro da neuropatia auditiva, também denominado dissincronia auditiva, é caracterizado por função neuronal auditiva anormal com função coclear normal; portanto, uma perda auditiva central. Também pode ocorrer alteração anormal do som de alta frequência, com alteração da fala, podendo evoluir para surdez total.2,15

Na maioria dos casos, o distúrbio auditivo é bilateral. Dessa maneira, os pacientes com sequelas auditivas desenvolvem dificuldades na linguagem, na fonação e no aprendizado. O tratamento da hiperbilirrubinemia levou a uma redução considerável na incidência de perda auditiva.2,15
Displasia do esmalte dos dentes
A displasia do esmalte dos dentes é uma anormalidade incomum que pode afetar os dentes quando o RN é exposto a níveis excessivos de bilirrubina. Os pigmentos ficam retidos definitivamente no esmalte dentário, sendo a coloração variável de acordo com a quantidade de bilirrubina aderida ao esmalte dentário (Figura 4). A pigmentação do dente pode variar de tom amarelo a verde. Vale ressaltar que essa displasia dentária poupa os dentes permanentes, afetando apenas os dentes decíduos (“dentes de leite”).2,15,16

FIGURA 4: Displasia dentária. // Fonte: Barbério e colaboradores (2018).16
Síndrome extrapiramidal
O envolvimento dos gânglios da base, do globo pálido e dos núcleos subtalâmicos, além do cerebelo e dos núcleos do tronco central, determinam, no RN, a atetose e a distonia do kernicterus. Muitas vezes, a hipertonia pode ser significativa, com postura distônica e movimentos anormais, com espasmo da musculatura e perda de movimentos voluntários.2,15
Quase todos os pacientes com kernicterus têm graus variáveis desse distúrbio do movimento. Nos casos mais graves, a coreoatetose se apresenta com envolvimento dos membros superiores e inferiores. Os movimentos dos membros são exibidos como coreia (movimentos rápidos e espasmódicos), tremor ou balismo (agitação de grande amplitude).2,15
Como existem graus variados de acometimento neurológico, Shapiro classificou o kernicterus como leve, moderado ou grave (Quadro 3).17
Quadro 3
|
CLASSIFICAÇÃO DO KERNICTERUS CONFORME INTENSIDADE E LOCALIZAÇÃO DE SEQUELA |
||
|
Intensidade |
Sequela auditiva |
Sequela motora |
|
Leve |
|
|
|
Moderada |
|
|
|
Grave |
|
|
// Fonte: Shapiro (2005).17
A deposição de bilirrubina indireta em outros órgãos além do cérebro, como células pancreáticas, células tubulares renais e mucosa intestinal, é observada na autópsia dos pacientes. As consequências em longo prazo da toxicidade da bilirrubina, nesses órgãos, não são especificadas.
Além da EBA e crônica, existe uma apresentação clínica conhecida como disfunção neurológica induzida por bilirrubina (do inglês, bilirrubin-induced neurological dysfunction [BIND]. Essa denominação é utilizada para distúrbios sutis de visão, audição, função neuromotora, fala, cognição, linguagem e anormalidades do tônus. Muitas vezes, essas alterações são imperceptíveis, e os exames específicos de imagem e de avaliação auditiva auxiliam na confirmação diagnóstica durante o acompanhamento clínico da criança nos primeiros anos de vida.1,2,4,15
Encefalopatia em recém-nascidos prematuros com 34 semanas ou menos de idade gestacional
Os RNs prematuros são mais suscetíveis às alterações no SNC, sendo extremamente vulneráveis ao desenvolvimento da encefalopatia bilirrubínica crônica. Muitos diagnósticos de kernicterus em crianças com história de prematuridade foram documentados de modo retrospectivo a partir do desenvolvimento de paralisia cerebral com achados de alterações de exames de neuroimagem e da avaliação auditiva característicos da encefalopatia bilirrubínica. 7,8,15
Adicionalmente, as manifestações clínicas da EBA no RN são atípicas, tornando-se difícil diferenciar a lesão do SNC induzida pela bilirrubina dos outros fatores que contribuem para a lesão de SNC na faixa de IG de 34 semanas ou menos.7,8,15

Em especial, os RN com menos de 32 semanas de IG não apresentam sinais clássicos de EBA, em consequência da imaturidade do SNC, podendo apenas evoluir com aumento de episódios de apneia com bradicardia e maior necessidade de suporte respiratório e do uso de xantinas nas duas primeiras semanas de vida.7,8,15
Vale ressaltar que os prematuros moderados e extremos impregnam o cérebro com níveis baixos de bilirrubina sérica — em torno de 8 a 12mg/dL. Essa condição enfatiza que nem todos os pacientes com kernicterus apresentam níveis elevados de bilirrubina. As diferenças de desenvolvimento na permeabilidade do SNC à bilirrubina justificam essa condição de vulnerabilidade.7,8,15

ATIVIDADES
4. Em relação aos sintomas que se manifestam no primeiro ano de vida após a EBA, assinale a alternativa correta.
A) Movimentos extrapiramidais e paralisa do olhar para cima.
B) Retardo dos marcos do neurodesenvolvimento.
C) Hipotonia, hiper-reflexia, atraso da habilidade motora, reflexo tônico cervical persistente e retardo dos marcos do neurodesenvolvimento.
C) Movimentos extrapiramidais, hipotonia e hiper-reflexia.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "C".
No primeiro ano de vida, são observados sintomas, como hipotonia, hiper-reflexia, atraso da habilidade motora, reflexo tônico cervical persistente e retardo dos marcos do neurodesenvolvimento. Os movimentos extrapiramidais surgem após alguns anos, e a paralisa do olhar para cima surge durante o final da primeira infância.
Resposta correta.
No primeiro ano de vida, são observados sintomas, como hipotonia, hiper-reflexia, atraso da habilidade motora, reflexo tônico cervical persistente e retardo dos marcos do neurodesenvolvimento. Os movimentos extrapiramidais surgem após alguns anos, e a paralisa do olhar para cima surge durante o final da primeira infância.
A alternativa correta e a "C".
No primeiro ano de vida, são observados sintomas, como hipotonia, hiper-reflexia, atraso da habilidade motora, reflexo tônico cervical persistente e retardo dos marcos do neurodesenvolvimento. Os movimentos extrapiramidais surgem após alguns anos, e a paralisa do olhar para cima surge durante o final da primeira infância.
5. Qual pode ser o único sintoma da encefalopatia induzida pela bilirrubina?
A) Atraso da habilidade motora.
B) Hiper-reflexia.
C) Perda auditiva neurossensorial.
D) Displasia dentária.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "C".
A perda auditiva neurossensorial pode ser o único sintoma da encefalopatia induzida pela bilirrubina.
Resposta correta.
A perda auditiva neurossensorial pode ser o único sintoma da encefalopatia induzida pela bilirrubina.
A alternativa correta e a "C".
A perda auditiva neurossensorial pode ser o único sintoma da encefalopatia induzida pela bilirrubina.
6. Sobre a encefalopatia em RNs prematuros com 34 semanas ou menos de IG, assinale V (verdadeiro) ou F (falso).
Os prematuros moderados e extremos impregnam o cérebro com níveis de bilirrubina sérica em torno de 15mg/dL.
Os RN com menos de 32 semanas de IG não apresentam sinais clássicos de EBA.
Nem todos os pacientes com kernicterus apresentam níveis elevados de bilirrubina.
As manifestações clínicas da EBA no RN são atípicas, tornando-se difícil diferenciar a lesão do SNC induzida pela bilirrubina de outros fatores que contribuem para a lesão de SNC nessa faixa de IG.
Assinale a alternativa que apresenta a sequência correta.
A) V — V — F — V
B) V — V — V — F
C) F — F — V — F
D) F — V — V — V
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "D".
Os prematuros moderados e extremos impregnam o cérebro com níveis baixos de bilirrubina sérica — em torno de 8 a 12mg/dL.
Resposta correta.
Os prematuros moderados e extremos impregnam o cérebro com níveis baixos de bilirrubina sérica — em torno de 8 a 12mg/dL.
A alternativa correta e a "D".
Os prematuros moderados e extremos impregnam o cérebro com níveis baixos de bilirrubina sérica — em torno de 8 a 12mg/dL.
Manejo da encefalopatia bilirrubínica aguda
Na fase inicial da EBA, cujos sintomas são inespecíficos, a fototerapia com alta irradiância na maior superfície corpórea exposta do RN pode reverter o quadro em poucas horas de tratamento. 2,4,18

A solicitação do sangue para a exsanguinotransfusão (EST) deve ser realizada, e a instalação do tratamento com fototerapia intensiva é uma emergência clínica, com início imediato do tratamento. Caso o RN tenha sinais de EBA intermediária e/ou avançada, além da instalação da fototerapia intensiva, a EST está indicada assim que o sangue estiver disponível.2,4,18 As dosagens de glicose, sódio, potássio, cálcio, magnésio, hemograma, reticulócito e dosagem de G6PD devem ser realizadas, além da classificação sanguínea, Coombs direto e prova cruzada do sangue para EST.
Fototerapia intensiva
O início do tratamento com fototerapia intensiva na maior superfície corpórea do RN com EBA deve ser imediato, antes mesmo do resultado de exames laboratoriais. É considerada intensiva a fototerapia com irradiância superior a 30μW/cm2/nm, que pode ser obtida com a utilização de uma fototerapia superior e uma inferior.1,2,4,19
As medidas de irradiância dos equipamentos de fototerapia devem ser realizadas com o radiômetro sob a pele do RN em cinco pontos (dois acima, na região da cabeça, um ponto central e dois próximos aos pés do RN). Realiza-se a soma dos cinco pontos e divide-se por 5, calculando a média espectral da irradiância. A escolha do equipamento adequado deve abranger toda a superfície corpórea do RN (Figura 5).1,2,4,19

FIGURA 5: Estratégia para aumentar a eficácia terapêutica. Dois equipamentos de fototerapia intensiva com lâmpadas azuis acima e abaixo do RN, abrangendo a maior superfície corpórea da criança. // Fonte: Arquivo de imagem das autoras.
A diminuição rápida da bilirrubinemia depende diretamente do nível sérico elevado da bilirrubina encontrado na EBA, que sofre a reação fotoquímica da ação da luz azul no comprimento de onda ideal de 450 a 470nm com aparelhos utilizando fototerapia intensiva com irradiância espectral aproximada de 30μW/cm2/nm. Quanto maior o número de moléculas de bilirrubina expostas à luz através dos capilares sanguíneos da pele, maior o declínio de bilirrubinemia. Consequentemente, níveis elevados de bilirrubinemia tendem a declinar rapidamente.1,2,4,19
Exsanguinotransfusão
Logo após a detecção da EBA, assim que o sangue estiver disponível, a EST deve ser realizada. A escolha do sangue deve ser criteriosa e cuidadosamente selecionada:20,21
- quando o RN tem hemoglobina maior do que 10g/dL, são realizadas trocas com duas volemias (2 x 80mL/kg), sendo o volume de dois terços de concentrado de hemácias e um terço de plasma fresco congelado;
- preferencialmente, o banco de sangue deve enviar a bolsa a ser utilizada na prática da EST reconstituída com hemácias sob coleta inferior a 7 dias, com sangue filtrado e irradiado com plasma fresco;
- se houver incompatibilidade Rh, utilizar sangue O negativo submetido à contraprova com o sangue materno;
- se houver incompatibilidade ABO, usar hemácias O reconstituídas em plasma AB ou receptor compatível;
- se houver doença hemolítica por outros anticorpos eritrocitários, optar por sangue compatível com o do RN e submetido à contraprova com o sangue da mãe;
- se houver hiperbilirrubinemia não hemolítica, usar sangue compatível com a tipagem sanguínea do RN e a contraprova obrigatória.
Os objetivos da EST são diminuir os níveis de bilirrubina e reduzir o risco de encefalopatia bilirrubínica. Com a técnica, há remoção das hemácias com anticorpos ligados e/ou circulantes, redução da bilirrubina e correção da anemia. O sangue deve estar disponível em 2 a 4 horas após a solicitação da reserva de EST.20,21

Os profissionais de saúde e os neonatologistas devem ser treinados para reconhecer a hiperbilirrubinemia neonatal grave, realizar o escore de BIND, bem como obter assepticamente um acesso vascular central e realizar a EST o mais rápido possível quando houver sinais de EBA. Com a técnica de EST, ocorre substituição de 85 a 90% das hemácias e diminuição de 50% de BT e frações.20,21
Técnica de exsanguinotransfusão
O RN deve ser monitorado e posicionado em ambiente estéril em bloco cirúrgico ou UTIN com acesso venoso central. A monitorização deve ser feita por meio de oximetria de pulso, frequência cardíaca (FC) e pressão arterial (PA), e a duração do procedimento deve ser entre 1 e 2 horas, da seguinte forma:
- aquecer o sangue até a temperatura corporal se houver dispositivo próprio disponível ou deixar de 10 a 15 minutos em ar ambiente (não colocar dentro da incubadora ou sob fonte de calor);
- preparar material de reanimação para utilização, se necessário;
- utilizar precauções padrão — usar máscara, touca, avental e luvas estéreis;
- fazer antissepsia local;
- colocar campos estéreis;
- montar o sistema — duas torneiras ligadas ao cateter; na primeira (proximal ao paciente), instalar o equipo do sangue e, na segunda, acoplar o equipo para descarte e a seringa. Banhar em solução com heparina (0,5mL em 1.000mL de soro fisiológico 0,9%);
- alíquotas:
- < 1.500g: 5mL;
- 1.500 a 2.500g: 10mL;
- 2.500 a 3.500g: 15mL;
- >3.500g: 20mL;
- abrir as vias da torneira para o RN e a seringa;
- aspirar o sangue do RN com seringa usando, inicialmente, duas alíquotas a fim de manter balanço negativo (utilizar esse sangue para os exames necessários); as trocas posteriores serão de uma alíquota;
- abrir a via para descarte, fechando a do RN, e desprezar o sangue no lixo;
- abrir a via da bolsa de sangue, fechando a do paciente, fechando, em seguida, a do descarte e aspirar o sangue da bolsa;
- fechar a via para a bolsa de sangue;
- abrir a via para o RN e infundir o sangue lentamente;
- repetir os passos até o término do sangue;
- registrar volumes retirados e infundidos;
- monitorizar alterações de FC, PA ou saturação de oxigênio (parar o procedimento temporariamente, se necessário);
- ao término, verificar funções vitais, glicemia, bilirrubinas, eletrólitos;
- retornar com fototerapia intensiva.
Atualmente, a maioria dos casos de hiperbilirrubinemia indireta é controlada pela fototerapia, sendo a doença hemolítica grave por incompatibilidade Rh a principal indicação de EST. No entanto, existem indicações precisas, quando há sinais de EBA e/ou níveis críticos de hiperbilirrubinemia indireta sem resposta à fototerapia intensiva adequada.20,21
Prevenção da encefalopatia bilirrubínica aguda
A neurotoxicidade da bilirrubina é uma doença devastadora, mas evitável. Um acompanhamento adequado do RN, com detecção precoce de hiperbilirrubinemia significativa e tratamento oportuno com fototerapia é uma estratégia preventiva e curativa.1,2,4,18,22
A educação dos cuidadores durante o atendimento pré-natal em relação aos grupos sanguíneos suscetíveis, o esclarecimento dos fatores de risco para surgimento da hiperbilirrubinemia, as orientações quanto ao sucesso e aos benefícios da amamentação adequada, a alta hospitalar após 48 horas de vida nas maternidades e a importância do acompanhamento podem ser muito eficazes na redução da encefalopatia induzida pela bilirrubina.1,2,4,18,22

A instituição do tratamento efetivo emergencial com agilidade da fototerapia intensiva e EST, nas primeiras horas da EBA, pode evitar o desenvolvimento da encefalopatia crônica.2,4
Existem pesquisas para avaliação de novas estratégias terapêuticas para reduzir as consequências neurológicas em longo prazo da encefalopatia bilirrubínica. Novas modalidades de tratamento estão sendo investigadas em pesquisas atuais como uma opção terapêutica final. Entre elas, estão:2
- minociclina como medicamento anti-inflamatório e antimicrobiano;
- hipotermia terapêutica para tornar as mitocôndrias mais eficientes, como principal fator biológico para lesão de células cerebrais induzida por bilirrubina;
- cafeína na toxicidade da bilirrubina em prematuros;
- agentes antiapoptóticos;
- terapias antioxidantes (eliminadores de radicais livres);
- tratamento com células-tronco.

ATIVIDADES
7. Sobre o manejo da EBA, assinale a alternativa correta.
A) As medidas de irradiância dos equipamentos de fototerapia devem ser realizadas com o radiômetro sob a pele do RN em dois pontos.
B) Caso o RN tenha sinais de EBA intermediária e/ou avançada, além da instalação da fototerapia intensiva, a EST está indicada assim que o sangue estiver disponível.
C) A neurotoxicidade da bilirrubina é uma doença inevitável, e a fototerapia não é um tratamento curativo.
D) Quando o RN tem hemoglobina maior do que 12g/dL, são realizadas trocas com três volemias.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "B".
As medidas de irradiância dos equipamentos de fototerapia devem ser realizadas com o radiômetro sob a pele do RN em cinco pontos (dois acima na região da cabeça, um central e dois próximos aos pés do RN). A neurotoxicidade da bilirrubina é uma doença devastadora, mas evitável. Um acompanhamento adequado do RN, com detecção precoce de hiperbilirrubinemia significativa e tratamento oportuno com fototerapia é uma estratégia preventiva e curativa. Quando o RN tem hemoglobina maior do que 10g/dL, são realizadas trocas com duas volemias.
Resposta correta.
As medidas de irradiância dos equipamentos de fototerapia devem ser realizadas com o radiômetro sob a pele do RN em cinco pontos (dois acima na região da cabeça, um central e dois próximos aos pés do RN). A neurotoxicidade da bilirrubina é uma doença devastadora, mas evitável. Um acompanhamento adequado do RN, com detecção precoce de hiperbilirrubinemia significativa e tratamento oportuno com fototerapia é uma estratégia preventiva e curativa. Quando o RN tem hemoglobina maior do que 10g/dL, são realizadas trocas com duas volemias.
A alternativa correta e a "B".
As medidas de irradiância dos equipamentos de fototerapia devem ser realizadas com o radiômetro sob a pele do RN em cinco pontos (dois acima na região da cabeça, um central e dois próximos aos pés do RN). A neurotoxicidade da bilirrubina é uma doença devastadora, mas evitável. Um acompanhamento adequado do RN, com detecção precoce de hiperbilirrubinemia significativa e tratamento oportuno com fototerapia é uma estratégia preventiva e curativa. Quando o RN tem hemoglobina maior do que 10g/dL, são realizadas trocas com duas volemias.
8. Sobre o mecanismo de ação da EST, assinale V (verdadeiro) ou F (falso).
Remoção da bilirrubina e correção da anemia.
Remoção do sangue do RN com anticorpos maternos.
Remoção de subprodutos tóxicos da hemólise.
Substituição da hemoglobina do adulto pela hemoglobina fetal.
Assinale a alternativa que apresenta a sequência correta.
A) V — V — F — V
B) F — F — F — V
C) F — F — V — F
D) V — V — V — F
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "D".
Os objetivos da EST são reduzir os níveis de bilirrubina e o risco de encefalopatia bilirrubínica. Com a técnica, há remoção das hemácias com anticorpos ligados e/ou circulantes, redução da bilirrubina e correção da anemia. O sangue deve estar disponível em 2 a 4 horas após a solicitação da reserva de EST.
Resposta correta.
Os objetivos da EST são reduzir os níveis de bilirrubina e o risco de encefalopatia bilirrubínica. Com a técnica, há remoção das hemácias com anticorpos ligados e/ou circulantes, redução da bilirrubina e correção da anemia. O sangue deve estar disponível em 2 a 4 horas após a solicitação da reserva de EST.
A alternativa correta e a "D".
Os objetivos da EST são reduzir os níveis de bilirrubina e o risco de encefalopatia bilirrubínica. Com a técnica, há remoção das hemácias com anticorpos ligados e/ou circulantes, redução da bilirrubina e correção da anemia. O sangue deve estar disponível em 2 a 4 horas após a solicitação da reserva de EST.
9. O que ocorre em relação à troca de sangue com duas volemias na EST?
A) Substituição de 45 a 50% das hemácias e diminuição de 20% de bilirrubina total e frações.
B) Substituição de 85 a 90% das hemácias e diminuição de 50% de bilirrubina total e frações.
C) Substituição de 50 a 65% das hemácias e diminuição de 30% de bilirrubina total e frações.
D) Substituição de 20 a 35% das hemácias e diminuição de 90% de bilirrubina total e frações.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "B".
Na técnica de EST com duas volemias, ocorre substituição de 85 a 90% das hemácias e diminuição de 50% de bilirrubina total e frações.
Resposta correta.
Na técnica de EST com duas volemias, ocorre substituição de 85 a 90% das hemácias e diminuição de 50% de bilirrubina total e frações.
A alternativa correta e a "B".
Na técnica de EST com duas volemias, ocorre substituição de 85 a 90% das hemácias e diminuição de 50% de bilirrubina total e frações.
Hipoglicemia
Definição
A glicose é a principal fonte de energia para o desenvolvimento fetal. Durante a gestação, sua homeostase depende inteiramente do fornecimento contínuo de glicose a partir da circulação materna. O transporte de glicose através da placenta é mediado por transportadores de glicose (do inglês, glucose transporter [GLUT]) e é dependente do gradiente de concentração materno-fetal.
Cerca de 70% da glicose materna é transportada para o feto, e os 30% restantes são consumidos pela placenta. O metabolismo da glicose fetal é regulado pela produção de insulina fetal que aumenta com a progressão da gravidez e é responsável pelo aumento da utilização da glicose por tecidos sensíveis à insulina, incluindo músculo esquelético, fígado, coração e tecido adiposo.23

Ao nascer, a interrupção da transferência contínua de glicose acarreta aumento consistente de catecolaminas plasmáticas, glucagon (e receptores glucagon) e cortisol e diminuição nos níveis de insulina plasmática. Essas alterações endócrinas são essenciais para induzir glicogenólise hepática e gliconeogênese, mantendo, assim, a homeostase da glicose. Além disso, lipólise, oxidação de ácidos graxos e proteólise colaboram ativamente para manter os níveis de glicemia no período neonatal.23
A glicogenólise hepática é o mecanismo mais rápido que permite aumento dos níveis de glicose no sangue após o nascimento. A gliconeogênese começa lentamente após algumas horas do nascimento e atinge seu amadurecimento após 12 horas de vida. A oxidação da glicose suporta cerca de 70% da necessidade de energia do cérebro. A cetogênese hepática aumenta significativamente durante as primeiras horas de vida para fornecer combustíveis alternativos para o metabolismo cerebral em RNs a termo. O atraso ou interrupção dessa adaptação metabólica pós-natal resulta em hipoglicemia neonatal.23
Apesar de sua frequência, a definição de hipoglicemia, no período neonatal, é controversa e, provavelmente, não existe um valor único de glicose plasmática. Diferentes valores de glicemia plasmática têm sido utilizados para definir hipoglicemia, mas nenhum é totalmente satisfatório.24
Durante a transição da vida intrauterina para a extrauterina, as concentrações plasmáticas de glicose são as mais baixas quando comparadas a qualquer outro período da vida. Em RNs a termo com peso adequado para IG e saudáveis, concentrações normais de glicose no sangue variam entre 25 e 110mg/dL nas primeiras horas após o nascimento. No entanto, após 72 horas de vida, esses valores de glicose normalmente atingem, pelo menos, 60 a 100mg/dL.25
Com base na opinião de especialistas, foi desenvolvido um conceito de limiares operacionais que consideram as concentrações de glicose entre 36mg/dL (2,0mmol/L) e 47mg/dL (2,6mmol/L) como aceitáveis por curtos períodos.24 Um resumo das principais opiniões dos especialistas sobre a definição de hipoglicemia neonatal é apresentado na Tabela 1.
Tabela 1
|
DEFINIÇÃO DE HIPOGLICEMIA (EM MG/DL) BASEADA NA OPINIÃO DE ESPECIALISTAS |
||||||
|
Instituição |
Horas de vida |
|||||
|
0–2 |
2–4 |
4–24 |
24–48 |
48–72 |
>72 |
|
|
AAP (2011)3 |
Assintomáticos 25–40 |
35–45 |
<45 |
— |
— |
|
|
Sintomáticos <40 |
<45 |
— |
— |
|||
|
ABM (2014)26 |
<28 |
— |
<40 |
— |
<48 |
— |
|
PES (2015)27 |
<50 |
— |
— |
<60 |
||
|
BAPM (2017)28 |
<45 se sintomático |
|||||
|
<36 em RNs de risco assintomáticos |
||||||
|
CPS (2019)29 |
— |
— |
<47 |
— |
— |
<60 |
|
SNG, 2020)30 |
— |
— |
<47 |
— |
— |
<54 |
AAP: American Academy of Pediatrics; ABM: Academy of Breastfeeding Medicine; BAPM: British Association of Perinatal Medicine; CPS: Canadian Pediatric Society; SNG: Swedish National Guidelines; PES: Pediatric Endocrine Society. // Fonte: Adaptada de De Angelis e colaboradores (2021).23
Hipoglicemia e lesão cerebral
A glicose é necessária para a função neuronal; no entanto, durante os períodos de hipoglicemia, existem vários mecanismos neuroprotetores no RN que evitam a lesão cerebral. Entre eles, estão aumento do fluxo sanguíneo cerebral, facilitando a absorção da glicose no cérebro, melhor capacidade de uso de substratos alternativos (especialmente corpos cetônicos), lactato e preservação de fosfatos cerebrais de alta energia. Mecanismos adicionais de proteção incluem estoques de glicogênio em astrócitos e taxa metabólica cerebral baixa em RNs, que é cerca de 30% menor do que em adultos.31
Os principais eventos induzidos pela hipoglicemia implicados na morte neuronal são:23
- ativação dos receptores de glutamato neuronal;
- estresse oxidativo e liberação de radicais livres;
- liberação neuronal de zinco;
- ativação do poly-ADP-ribose polymerase-1 (PARP1).
Ativação dos receptores de glutamato neuronal
A hipoglicemia causa despolarização neuronal, resultando em elevações significativas nas concentrações de glutamato no espaço extracelular cerebral. A ativação sustentada do receptor de glutamato é o primeiro passo do processo que leva à morte celular neuronal.
Estresse oxidativo
Em resposta à citotoxicidade do glutamato, as mitocôndrias cerebrais apresentam capacidade aumentada de gerar radicais livres que desempenham um papel crítico na morte celular neuronal. Observou-se que a produção desses radicais livres, em neurônios afetados pela hipoglicemia, ocorre principalmente durante a reperfusão de glicose.
Liberação neuronal de zinco
O zinco (como Zn2+) é um neuromodulador armazenado dentro de vesículas em terminais pré-sinápticos e é intensamente liberado no espaço extracelular durante condições patológicas, como isquemia, convulsão, trauma cerebral e hipoglicemia. O zinco afeta significativamente a atividade de muitos receptores, incluindo receptores N-metil D-aspartato (NMDA), ácido gama-aminobutírico (Gaba-A), adenosina trifosfato (ATP) e glicina, bem como canais de sódio e cálcio e tem sido associado com a promoção da morte neuronal.
O zinco induz também disfunção mitocondrial, desencadeando despolarização mitocondrial e levando à ativação do PARP-1, provavelmente como resultado do aumento da produção de radicais livres de oxigênio. Além disso, inibe a glicólise ao nível da gliceraldeído-3-fosfato desidrogenase (GAPDH), contribuindo para diminuição de glicose cerebral.
Ativação do poly-ADP-ribose polymerase-1
A ativação do PARP1 facilita a reparação do DNA; contudo, sua ativação extensiva causada por uma ação sustentada de glutamato induz transição de permeabilidade mitocondrial e danos mitocondriais que culminam em morte celular.
Ressonância magnética e topografia das lesões
Outro tema controverso no campo da hipoglicemia neonatal é a correlação entre o evento hipoglicêmico e a lesão cerebral visualizada pela RM. Estudos mais antigos descreveram uma predominância de anormalidades envolvendo os lobos occipitais e regiões parietotemporais posteriores. Isso levou muitos autores a acreditarem que um padrão de lesão occipital seria bastante específico para hipoglicemia neonatal.32
Uma publicação mais recente, no entanto, realizada em uma grande coorte de bebês sintomáticos com hipoglicemia mostrou que os padrões de lesões cerebrais detectados nos primeiros exames de RM são mais variados, incluindo lesão de substância branca no lobo posterior, no córtex, nos gânglios da base, na região de tálamo e na cápsula interna.33
Efeitos da hipoglicemia no neurodesenvolvimento
A hipoglicemia neonatal tem sido associada a várias formas de comprometimento neurológico, incluindo atraso no desenvolvimento, convulsões, problemas de processamento visual e dificuldades cognitivas. Porém, muitas perguntas sobre quais pacientes estão mais em risco, a correlação da imagem da RM com os desfechos neurológicos e o acompanhamento permanecem sem resposta.
A maioria das evidências dos efeitos da hipoglicemia neonatal no neurodesenvolvimento vem de estudos observacionais retrospectivos, sendo que poucos deles controlaram fatores de confusão ou analisaram resultados além da primeira infância. Ainda, existe alta heterogeneidade entre os estudos, o que torna difícil a comparação dos desfechos.
Uma revisão sistemática de seis estudos de coorte com tamanho amostral de 1.675 bebês mostrou que a hipoglicemia neonatal (definição de glicemia plasmática variando entre 20 e 47mg/dL) não estava associada a comprometimento do neurodesenvolvimento, cognitivo ou motor entre 2 e 5 anos de idade. No entanto, a hipoglicemia neonatal esteve associada a um risco 2 a 3 vezes maior de deficiência visual-motora e disfunção executiva aos 4 anos de idade. Esses riscos foram maiores em crianças que experimentaram hipoglicemia neonatal grave, recorrente ou clinicamente não detectada.34
Em crianças mais velhas, dados limitados (dois estudos com tamanho amostral de 54 bebês) mostraram que a hipoglicemia neonatal estava associada a um risco três vezes maior de comprometimento do neurodesenvolvimento entre 6 e 11 anos de idade, e um aumento de duas vezes em alterações de numeração e alfabetização. Não foram relatados estudos sobre os desfechos da hipoglicemia em adolescentes. Importante salientar que as evidências encontradas nessa revisão foram consideradas de baixa qualidade.34

Integração visual-motora é a coordenação da percepção visual (capacidade de extrair e organizar informações visuais do ambiente) e habilidades motoras, especialmente as motoras finas. Permite o uso de olhos e mãos de forma coordenada e eficiente, possibilitando, por exemplo, perceber e copiar formas, letras e números. Assim, a integração visual-motora é importante para o aprendizado e o desempenho acadêmico, incluindo leitura, escrita e matemática.
Acredita-se que a coordenação da função visual-motora ocorra dentro dos fluxos visuais corticais ventral e dorsal. O fluxo ventral suporta processamento de formulários e reconhecimento de objetos, e inclui córtex visual primário occipital e lobo temporal inferior. O fluxo dorsal é responsável pela percepção de movimento e função motora visualmente guiada e inclui córtex visual primário occipital, lobo temporal médio e lobo parietal posterior. No período neonatal, essas áreas corticais parecem ser particularmente suscetíveis a lesões por neuroglicopenia, possivelmente em função de sua maior atividade metabólica. Isso fornece uma possível base fisiopatológica para a associação entre hipoglicemia neonatal e integração visual-motora prejudicada na primeira infância.

A função executiva é a capacidade coletiva de resolução de problemas, planejamento, controle de atenção e comportamento direcionado a metas. Crianças com controle executivo prejudicado têm dificuldade de lembrar e realizar instruções, manter-se focadas e planejar e monitorar o progresso com uma tarefa específica, o que pode afetar não só as atividades cotidianas, mas, também, a aprendizagem.
O córtex pré-frontal é responsável pelo desenvolvimento adequado da função executiva, e estudos recentes de RM, em bebês com hipoglicemia, sugerem que seus efeitos no cérebro podem ser mais difundidos, e incluem o córtex frontal interferindo potencialmente no desenvolvimento normal da capacidade executiva.
As demandas pela função visual-motora e executiva aumentam com a idade, mas não foi possível determinar se as mudanças observadas na primeira infância, após a hipoglicemia neonatal, persistem ou pioram ao longo do tempo, em função da falta de dados de desfecho em longo prazo. No entanto, a constatação de um duplo aumento do risco de alfabetização e problemas de numeração entre 6 e 11 anos de idade sugere uma trajetória de piora da função em habilidades que são importantes para o aprendizado. O fato de a hipoglicemia neonatal estar associada ao comprometimento cognitivo geral entre 6 e 11 anos, mas não na primeira infância, sustenta essa hipótese.
Um resultado interessante de um dos estudos incluídos nessa revisão sistemática foi a associação de atraso cognitivo com maior concentração de glicose e menor estabilidade da glicose após o tratamento, observada como um tempo maior de glicemia plasmática fora da faixa de 54 a 72mg/dL nos dois primeiros dias de vida. Os autores sugerem que a lesão por reperfusão de glicose, no caso de correção excessivamente rápida ou intensa da hipoglicemia, pode exacerbar o estresse oxidativo, mesmo que os dados sobre o efeito biológico da variabilidade glicêmica em RNs estejam quase ausentes na literatura.35
Em estudos animais, maiores concentrações de glicose após hipoglicemia podem piorar a lesão neuronal em virtude da geração de radicais livres e alterações na perfusão cerebral. Resta determinar se a instabilidade da glicose é a causa da lesão neuronal ou se é simplesmente um marcador de estresse perinatal.35
Prevenção de lesões cerebrais secundárias à hipoglicemia neonatal
Apesar de a prevenção da hipoglicemia neonatal ainda ser um desafio, algumas medidas podem ser realizadas na tentativa de prevenir alterações cerebrais. Entre essas medidas, estão:
- triagem para hipoglicemia dos RNs de risco;
- aleitamento materno precoce e exclusivo e contato pele a pele;
- utilização de gel de dextrose em RNs de risco;
- tratamento imediato de RNs sintomáticos com glicose intravenosa (IV).
Triagem para hipoglicemia neonatal
Os sinais clínicos de hipoglicemia neonatal incluem letargia, hipotonia, dificuldade de sucção, cianose, tremores, taquicardia, apneia e convulsões. No entanto, como muitos desses sinais são inespecíficos e a maioria dos bebês com baixas concentrações de glicose não apresenta sinais clínicos, recomenda-se que todos os bebês com fatores de risco sejam submetidos a monitoramento regular da glicose. A frequência ideal e a duração dessa triagem, porém, permanecem incertas.3

A maioria dos protocolos recomenda a triagem dentro de 1 a 4 horas após o nascimento e, em seguida, a cada 3 ou 4 horas, até que a euglicemia seja mantida ao longo de 2 ou 3 medidas consecutivas de glicose.3
Vale ressaltar que todas essas diretrizes são formadas pela opinião de especialistas e carecem de uma base de evidências confiável. Alguns especificam diferentes períodos de monitoramento dependentes do perfil clínico do bebê; por exemplo, a AAP recomenda que o monitoramento continue até 12 horas após o nascimento para bebês de mães diabéticas ou grandes para IG e até 24 horas nos bebês prematuros tardios ou pequenos para IG.3 Não há evidências que sugiram que os requisitos de glicose cerebral variem entre grupos de risco.36
Um estudo que examinou bebês de risco utilizando o método de oxidase de glicose 1 a 2 horas após o nascimento, em seguida, a cada 3 a 4 horas antes das dietas para as primeiras 24 horas de vida e a cada 3 a 8 horas de 24 a 48 horas não relatou diferença entre grupos na incidência ou gravidade da hipoglicemia neonatal, sugerindo que um único protocolo de triagem seria razoável para todos os bebês em risco (Quadro 4).36
Quadro 4
|
RECÉM-NASCIDOS DE RISCO PARA HIPOGLICEMIA |
|
|
Hipoglicemia transitória |
Hipoglicemia persistente (≥3 dias) |
|
Prematuro |
Hipopituitarismo (deficiência de ACTH e GH) |
|
Pequeno para IG |
Insuficiência adrenal (deficiência de cortisol) |
|
Grande para IG |
Hipoglicemia hiperinsulinêmica neonatal persistente |
|
Filho de mãe diabética |
Síndrome de Beckwith-Wiedemann |
|
Estresse perinatal (asfixia, hipotermia e sepse) |
Glicogenose |
|
Uso materno de betabloqueador ou beta-agonistas |
Galactosemia |
|
Cardiopatia congênita complexa |
Defeitos de beta-oxidação |
|
Doença hemolítica por incompatibilidade Rh |
|
|
Policitemia |
|
ACTH: hormônio adrenocorticotrófico; GH: hormônio de crescimento. // Fonte: Adaptado de Edwards e Harding (2021).37
Aleitamento materno precoce e contato pele a pele
O aleitamento materno precoce e exclusivo atende às necessidades nutricionais e metabólicas de RNs a termo saudáveis e pode reduzir o risco de hipoglicemia. Uma análise secundária recente do estudo de gel de dextrose mostrou que os bebês em aleitamento materno tiveram menos episódios recorrentes de hipoglicemia quando comparados aos que receberam fórmula láctea.38

A prática do contato pele a pele pode reduzir a incidência de hipoglicemia neonatal, pois ajuda a manter uma temperatura corporal adequada, reduzindo, assim, o gasto energético e o consumo de glicose, ao mesmo tempo que estimula a produção de leite.
Além disso, uma revisão da Cochrane com três ensaios randomizados e 144 bebês saudáveis de baixo peso ao nascer mostrou que o contato pele a pele, durante o estabelecimento do aleitamento materno, foi associado à concentração média de glicose no sangue de 10mg/dL (0,6mmol/L) a mais em 75 a 90 minutos após o nascimento em comparação com o contato padrão.39
Uma combinação dessas duas intervenções pode ser benéfica na prevenção da hipoglicemia. Um estudo pré e pós-intervenção em 478 RN prematuros com 35 semanas ou mais de IG, de risco para hipoglicemia, reportou que o aleitamento materno precoce e o contato pele a pele reduziram a taxa de transferência para UTIN de 17 para 3%, e a porcentagem de bebês transferidos para essa unidade que não necessitaram de glicose IV diminuiu de 5 para 0,7% após intervenção.40
Utilização de gel de dextrose em recém-nascidos de risco
A prevenção da hipoglicemia com gel de dextrose foi recentemente proposta como uma alternativa à introdução de alimentação artificial, promovendo, assim, o aleitamento materno. O gel de dextrose utilizado nos estudos foi concentrado em solução aquosa a 40%, aplicado na mucosa oral e da língua, na dose de 200 a 400mg/kg, com absorção e acesso na corrente sanguínea rápidos.
Uma metanálise com alta qualidade de evidência com dois estudos e um total de 2.548 RNs prematuros tardios e a termo de risco para hipoglicemia mostrou que o gel de dextrose reduziu o risco de hipoglicemia em 13% quando comparado com gel de placebo.41 Porém, o gel de glicose não está disponível em nosso meio.
Tratamento imediato de recém-nascidos sintomáticos
O objetivo do tratamento da hipoglicemia neonatal é prevenir ou minimizar lesões cerebrais mantendo a concentração de glicose acima de 50mg/dL nas primeiras 48 horas e acima de 60mg/dL após esse período.37

É universalmente aceito que bebês sintomáticos devem ser prontamente tratados, a fim de evitar hipoglicemia grave e prolongada que pode resultar em lesão neurológica. A abordagem inicial deve ser bolo de 200mg/kg de glicose IV seguida de uma infusão contínua de 4 a 8mg/kg/min.37
O manejo da hipoglicemia em RNs assintomáticos é discutível na literatura. Não existe consenso quanto à concentração de glicose limiar na qual o tratamento para hipoglicemia neonatal assintomática deve ser iniciado. O tratamento excessivo acarreta maior número de coletas de sangue, uso de fórmulas lácteas, admissão em UTINs, separação da mãe, diminuição no sucesso do aleitamento materno, necessidade de acesso IV e piora no desenvolvimento quando realizado de maneira rápida.
Por outro lado, o subtratamento pode levar a alterações do neurodesenvolvimento, progressão de bebês assintomáticos para sintomáticos e retardo no diagnóstico e no tratamento de doenças endócrinas, como hiperinsulinismo, hipopituitarismo, insuficiência adrenal ou erros inatos do metabolismo.

A suplementação com leite associada a medidas repetidas de glicose representa o tratamento inicial para hipoglicemia assintomática em RNs de risco. Uma alternativa recomendada por alguns autores é o uso do gel de dextrose oral, 200mg/kg, (0,5mL/kg de 40% de dextrose), em combinação com a alimentação para tratamento da hipoglicemia neonatal assintomática.
Em bebês com glicemia muito baixa ou hipoglicemia persistente, apesar da suplementação de leite, deve-se iniciar a administração de glicose IV. No entanto, com os resultados dos últimos estudos publicados na literatura, que mostram que um aumento rápido da glicemia pode estar associado a pior desenvolvimento em longo prazo, os autores recomendam a não realização do bolo de glicose (200mg/kg) e o monitoramento de perto da glicemia para titular a infusão de glicose a fim de evitar hiperglicemia, oscilações glicêmicas significativas ou episódios recorrentes de hipoglicemia, que estão associados a risco aumentado de dano neurológico.42
A hipoglicemia grave ou prolongada, indicada por necessidade de glicose IV persistentemente alta ou contínua (≥3 dias) sugere patologia endócrina ou metabólica subjacente e merece investigação (Quadro 5). Nesses casos, podem ser necessários tratamentos adicionais, como diazóxido, glucagon ou glicocorticoides.
Quadro 5
|
INVESTIGAÇÃO DE HIPOGLICEMIA PERSISTENTE OU QUE NECESSITA DE ALTAS DOSES DE GLICOSE INTRAVENOSA |
|
Sangue:
|
|
Urina:
|
|
Outros:
|
ACTH: hormônio adrenocorticotrófico; GH: hormônio de crescimento; RM: ressonância magnética. // Fonte: Elaborado pelas autoras.

ATIVIDADES
10. Qual o principal substrato energético na vida fetal?
A) Corpos cetônicos.
B) Glicose.
C) Aminoácidos.
D) Lactato.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "B".
A glicose é o principal substrato energético fetal, apesar de o feto poder lançar mão de outros substratos alternativos no momento de privação de glicose.
Resposta correta.
A glicose é o principal substrato energético fetal, apesar de o feto poder lançar mão de outros substratos alternativos no momento de privação de glicose.
A alternativa correta e a "B".
A glicose é o principal substrato energético fetal, apesar de o feto poder lançar mão de outros substratos alternativos no momento de privação de glicose.
11. Quais são os mecanismos de lesão cerebral da hipoglicemia?
Confira aqui a resposta
Os principais eventos induzidos pela hipoglicemia implicados na morte neuronal são ativação dos receptores de glutamato nos neurônios, estresse oxidativo e liberação de radicais livres, liberação neuronal de zinco, além da ativação do PARP1.
Resposta correta.
Os principais eventos induzidos pela hipoglicemia implicados na morte neuronal são ativação dos receptores de glutamato nos neurônios, estresse oxidativo e liberação de radicais livres, liberação neuronal de zinco, além da ativação do PARP1.
Os principais eventos induzidos pela hipoglicemia implicados na morte neuronal são ativação dos receptores de glutamato nos neurônios, estresse oxidativo e liberação de radicais livres, liberação neuronal de zinco, além da ativação do PARP1.
12. Sobre as alterações cerebrais patológicas mais comuns na hipoglicemia, assinale a alternativa correta.
A) Lesão hemorrágica.
B) Lesão isquêmica em cerebelo.
C) Desmielinização da substância branca.
D) Lesão da matriz germinativa.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "C".
Estudos de RM mostram que a principal lesão na hipoglicemia é a desmielinização da substância branca.
Resposta correta.
Estudos de RM mostram que a principal lesão na hipoglicemia é a desmielinização da substância branca.
A alternativa correta e a "C".
Estudos de RM mostram que a principal lesão na hipoglicemia é a desmielinização da substância branca.
13. A respeito dos RNs que devem receber monitoração glicêmica, assinale V (verdadeiro) ou F (falso).
RNPT.
RN a termo adequado para IG.
Filho de mãe diabética.
RN a termo pequeno para IG.
Assinale a alternativa que apresenta a sequência correta.
A) F — V — F — F
B) V — F — V — V
C) V — V — F — F
D) F — F — V — V
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "B".
Entre os RNs de risco para hipoglicemia, estão os prematuros, os pequenos para IG, os grandes para IG, os filhos de mãe diabética e os com asfixia, hipotermia, sepse, cardiopatia congênita complexa, doença hemolítica por incompatibilidade Rh, policitemia e hipotermia.
Resposta correta.
Entre os RNs de risco para hipoglicemia, estão os prematuros, os pequenos para IG, os grandes para IG, os filhos de mãe diabética e os com asfixia, hipotermia, sepse, cardiopatia congênita complexa, doença hemolítica por incompatibilidade Rh, policitemia e hipotermia.
A alternativa correta e a "B".
Entre os RNs de risco para hipoglicemia, estão os prematuros, os pequenos para IG, os grandes para IG, os filhos de mãe diabética e os com asfixia, hipotermia, sepse, cardiopatia congênita complexa, doença hemolítica por incompatibilidade Rh, policitemia e hipotermia.

|
1 |
RN do sexo masculino, com 35,4 semanas de IG e peso ao nascer de 2.790g. O parto normal ocorreu sem intercorrências, sendo realizado o clampeamento tardio do cordão e o contato pele a pele na sala de parto. O RN foi encaminhado ao alojamento conjunto com 2 horas de vida. Recebeu alta hospitalar com 32 horas de vida. Está ictérico zona I. A classificação sanguínea materna e do RN era semelhante (A+).
No quinto dia de vida, o bebê apresentou sonolência, dificuldade para mamar e coloração amarela intensa dos olhos e da pele dos pés e das mãos. A consulta estava agendada para o sétimo dia de vida, porém ele evoluiu com irritabilidade, choro constante, e a mãe procurou a emergência pediátrica.
Ao exame físico, o paciente apresentava icterícia até zona V, estava corado, irritado, com hipertonia, retrocolo e opistótono. Apresentou peso de 2.350g e BT de 25mg/dL.

ATIVIDADES
14. Qual a conduta terapêutica adequada para esse caso?
A) Instalar fototerapia intensiva imediatamente, com irradiância de 20μW/cm2/nm.
B) Solicitar sangue para EST e repetir bilirrubina após 6 horas de fototerapia intensiva de 30μW/cm2/nm para avaliar necessidade de EST.
C) Instalar fototerapia imediatamente, com irradiância de 30μW/cm2/nm; solicitar sangue para EST e realizar o procedimento o mais rápido possível.
D) Instalar fototerapia intensiva com irradiância de 20μW/cm2/nm na maior superfície corpórea do RN; repetir a bilirrubina com 2 horas para avaliar necessidade de EST.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "C".
O início do tratamento com fototerapia intensiva, na maior superfície corpórea do RN com EBA, deve ser imediato, antes mesmo do resultado de exames laboratoriais. É considerada intensiva a fototerapia com irradiância superior a 30μW/cm2/nm, que pode ser obtida com a utilização de uma fototerapia superior e uma inferior. Logo após a detecção da EBA, assim que o sangue estiver disponível, a EST deve ser realizada.
Resposta correta.
O início do tratamento com fototerapia intensiva, na maior superfície corpórea do RN com EBA, deve ser imediato, antes mesmo do resultado de exames laboratoriais. É considerada intensiva a fototerapia com irradiância superior a 30μW/cm2/nm, que pode ser obtida com a utilização de uma fototerapia superior e uma inferior. Logo após a detecção da EBA, assim que o sangue estiver disponível, a EST deve ser realizada.
A alternativa correta e a "C".
O início do tratamento com fototerapia intensiva, na maior superfície corpórea do RN com EBA, deve ser imediato, antes mesmo do resultado de exames laboratoriais. É considerada intensiva a fototerapia com irradiância superior a 30μW/cm2/nm, que pode ser obtida com a utilização de uma fototerapia superior e uma inferior. Logo após a detecção da EBA, assim que o sangue estiver disponível, a EST deve ser realizada.
15. Em relação à EBA, nesse caso, assinale a alternativa correta.
A) As manifestações clínicas da EBA de irritabilidade e de hipertonia são os primeiros sinais da doença na primeira semana de vida.
B) A bilirrubina de 25mg/dL não justifica o quadro neurológico do bebê, pois a EBA, geralmente, ocorre quando os níveis de bilirrubina ultrapassam 30mg/dL.
C) Na fase avançada da EBA, o dano cerebral é reversível na maioria dos casos e se observa choro constante, febre, estupor ou coma, convulsões e agravamento do opistótono.
D) Nos RNs sobreviventes à EBA, ocorre melhora aparente, até que, em período variável, aparecem sequelas neurológicas características da encefalopatia aguda, denominadas kernicterus.
Confira aqui a resposta
Resposta incorreta. A alternativa correta e a "D".
Não existe um valor exato para definir o quadro da EBA. Sabe-se que, nos RNs com 35 semanas ou mais de IG, a EBA é caracterizada por alterações progressivas no estado mental, no comportamento e no tônus muscular, sendo dividida em três fases. Na fase inicial, o RN desenvolve sintomas inespecíficos (letargia, hipotonia e debilidade de sucção), progredindo, em 3 a 5 dias, para a fase intermediária (com estupor, irritabilidade e hipertonia, opistótono e/ou retrocolo). Nesse período, a hipertermia pode ser detectada com choro intenso e irritabilidade. A hipertonia dos músculos extensores é caracterizada por arqueamento cervical (retrocolo) ou do tronco (opistótono). Se não tratada em tempo hábil, evolui para a fase avançada e/ou óbito. Na fase avançada, o dano cerebral é irreversível na maioria dos casos e observam-se choro constante, febre, estupor ou coma, e as convulsões podem ocorrer, com agravamento do opistótono. Nos RNs que sobrevivem à EBA, há melhora aparente, até que, em período variável, aparecem as sequelas neurológicas características da encefalopatia aguda, o kernicterus.
Resposta correta.
Não existe um valor exato para definir o quadro da EBA. Sabe-se que, nos RNs com 35 semanas ou mais de IG, a EBA é caracterizada por alterações progressivas no estado mental, no comportamento e no tônus muscular, sendo dividida em três fases. Na fase inicial, o RN desenvolve sintomas inespecíficos (letargia, hipotonia e debilidade de sucção), progredindo, em 3 a 5 dias, para a fase intermediária (com estupor, irritabilidade e hipertonia, opistótono e/ou retrocolo). Nesse período, a hipertermia pode ser detectada com choro intenso e irritabilidade. A hipertonia dos músculos extensores é caracterizada por arqueamento cervical (retrocolo) ou do tronco (opistótono). Se não tratada em tempo hábil, evolui para a fase avançada e/ou óbito. Na fase avançada, o dano cerebral é irreversível na maioria dos casos e observam-se choro constante, febre, estupor ou coma, e as convulsões podem ocorrer, com agravamento do opistótono. Nos RNs que sobrevivem à EBA, há melhora aparente, até que, em período variável, aparecem as sequelas neurológicas características da encefalopatia aguda, o kernicterus.
A alternativa correta e a "D".
Não existe um valor exato para definir o quadro da EBA. Sabe-se que, nos RNs com 35 semanas ou mais de IG, a EBA é caracterizada por alterações progressivas no estado mental, no comportamento e no tônus muscular, sendo dividida em três fases. Na fase inicial, o RN desenvolve sintomas inespecíficos (letargia, hipotonia e debilidade de sucção), progredindo, em 3 a 5 dias, para a fase intermediária (com estupor, irritabilidade e hipertonia, opistótono e/ou retrocolo). Nesse período, a hipertermia pode ser detectada com choro intenso e irritabilidade. A hipertonia dos músculos extensores é caracterizada por arqueamento cervical (retrocolo) ou do tronco (opistótono). Se não tratada em tempo hábil, evolui para a fase avançada e/ou óbito. Na fase avançada, o dano cerebral é irreversível na maioria dos casos e observam-se choro constante, febre, estupor ou coma, e as convulsões podem ocorrer, com agravamento do opistótono. Nos RNs que sobrevivem à EBA, há melhora aparente, até que, em período variável, aparecem as sequelas neurológicas características da encefalopatia aguda, o kernicterus.

|
2 |
RN a termo com peso de nascimento de 4.200g, mãe diabética, insulino-dependente, nascido de parto cesáreo por desproporção cefalopélvica, com Apgar de 8 e 9, apresentou tremores de extremidades com 2 horas de vida.

ATIVIDADES
16. Qual é o diagnóstico mais provável do paciente?
Confira aqui a resposta
O diagnóstico mais provável do paciente é hipoglicemia, por se tratar de um RN grande para IG e filho de mãe diabética insulino-dependente. O diagnóstico diferencial deve ser realizado com hipocalcemia e hipomagnesemia, que também ocorrem no filho de mãe diabética, mas menos frequentemente.
Resposta correta.
O diagnóstico mais provável do paciente é hipoglicemia, por se tratar de um RN grande para IG e filho de mãe diabética insulino-dependente. O diagnóstico diferencial deve ser realizado com hipocalcemia e hipomagnesemia, que também ocorrem no filho de mãe diabética, mas menos frequentemente.
O diagnóstico mais provável do paciente é hipoglicemia, por se tratar de um RN grande para IG e filho de mãe diabética insulino-dependente. O diagnóstico diferencial deve ser realizado com hipocalcemia e hipomagnesemia, que também ocorrem no filho de mãe diabética, mas menos frequentemente.
17. Qual conduta deve ser tomada em relação a esse paciente?
Confira aqui a resposta
A conduta mais indicada para esse caso é a realização da glicemia capilar e, se esta for baixa, realizar confirmação com glicemia plasmática. Em se confirmando a hipoglicemia, a conduta seria a infusão IV de um bolo de glicose seguida de uma infusão contínua de glicose, por se tratar de um RN com hipoglicemia sintomática.
Resposta correta.
A conduta mais indicada para esse caso é a realização da glicemia capilar e, se esta for baixa, realizar confirmação com glicemia plasmática. Em se confirmando a hipoglicemia, a conduta seria a infusão IV de um bolo de glicose seguida de uma infusão contínua de glicose, por se tratar de um RN com hipoglicemia sintomática.
A conduta mais indicada para esse caso é a realização da glicemia capilar e, se esta for baixa, realizar confirmação com glicemia plasmática. Em se confirmando a hipoglicemia, a conduta seria a infusão IV de um bolo de glicose seguida de uma infusão contínua de glicose, por se tratar de um RN com hipoglicemia sintomática.
Conclusão
A EBA ainda ocorre no Brasil e no mundo. Na fase aguda da encefalopatia bilirrubínica, a intervenção precoce com fototerapia e EST pode prevenir a progressão da toxicidade da bilirrubina. Até o momento, não há informações definitivas sobre o tempo de duração exato da hiperbilirrubinemia grave e o início da encefalopatia bilirrubínica.2,4,22
Sabe-se que, em casos de hiperbilirrubinemia extrema, especialmente em bebês doentes e prematuros e em RNs com doença hemolítica subjacente, atrasar o início do tratamento aumenta o risco de encefalopatia induzida pela bilirrubina.2,4,22
Embora haja tratamento para hiperbilirrubinemia extrema e para a EBA, não há cura para as consequências da encefalopatia bilirrubínica crônica; a reabilitação e a socialização da criança e da família são as únicas estratégias terapêuticas para o kernicterus. Crianças com neuropatia auditiva e perda auditiva parecem responder favoravelmente ao implante coclear.2,4,15
Em conclusão, é um grande desafio reduzir as taxas de EBA em países de média e baixa renda, tornando-se um problema de saúde pública. Protocolos definidos de forma clara, treinamento e educação continuada aos profissionais de saúde em assistência básica, monitoramento e documentação precisa, junto com tecnologias simples e inovadoras de custo acessível podem evitar casos de EBA.
A hipoglicemia neonatal também é uma condição desafiadora. A transição da homeostase glicêmica ao nascer leva à redução temporária dos níveis de glicose no sangue nas primeiras horas de vida, que, raramente, é sintomática em bebês saudáveis. No entanto, a ausência de valores claros para definição de hipoglicemia nas primeiras horas de vida e a falta de diretrizes universalmente aceitas tornam seu diagnóstico e tratamento incertos.
Embora tenha sido demonstrado um papel causal de hipoglicemia em alterações no neurodesenvolvimento, uma topografia precisa da lesão cerebral ainda não está esclarecida. A variabilidade interpessoal na homeostase da glicose e os efeitos confusos das comorbidades, especialmente em bebês prematuros, podem explicar, em grande parte, os resultados controversos dos estudos.
Além disso, o efeito das oscilações glicêmicas frequentemente associadas ao tratamento da hipoglicemia pode desempenhar um papel importante no aumento do risco de lesões cerebrais, possivelmente pelo aumento das respostas oxidativas ao estresse. Embora poucas evidências estejam disponíveis para estabelecer precisamente diretrizes operacionais para reduzir as alterações cerebrais relacionadas à hipoglicemia, é importante avaliar cuidadosamente seus possíveis fatores de risco, apoiar intensamente o aleitamento materno e titular precisamente a dose de glicose.
Atividades: Respostas
Comentário: As principais causas associadas à encefalopatia bilirrubínica são as doenças hemolíticas por incompatibilidade Rh e ABO e, nas últimas décadas, tem sido descrita encefalopatia bilirrubínica em prematuros tardios com dificuldade no aleitamento e que recebem alta hospitalar precoce.
Comentário: Nem todos os casos de EBA progridem para kernicterus e nem todos os pacientes com encefalopatia bilirrubínica crônica têm uma história anterior de encefalopatia bilirrubínica clássica, principalmente os prematuros. Nesse grupo de RNs, muitas vezes, a identificação é retrospectiva, com avaliação de exames de imagem e triagem auditiva.
Comentário: Os sinais neurológicos definitivos de EBA são observados em 55 a 60% dos pacientes.
Comentário: No primeiro ano de vida, são observados sintomas, como hipotonia, hiper-reflexia, atraso da habilidade motora, reflexo tônico cervical persistente e retardo dos marcos do neurodesenvolvimento. Os movimentos extrapiramidais surgem após alguns anos, e a paralisa do olhar para cima surge durante o final da primeira infância.
Comentário: A perda auditiva neurossensorial pode ser o único sintoma da encefalopatia induzida pela bilirrubina.
Comentário: Os prematuros moderados e extremos impregnam o cérebro com níveis baixos de bilirrubina sérica — em torno de 8 a 12mg/dL.
Comentário: As medidas de irradiância dos equipamentos de fototerapia devem ser realizadas com o radiômetro sob a pele do RN em cinco pontos (dois acima na região da cabeça, um central e dois próximos aos pés do RN). A neurotoxicidade da bilirrubina é uma doença devastadora, mas evitável. Um acompanhamento adequado do RN, com detecção precoce de hiperbilirrubinemia significativa e tratamento oportuno com fototerapia é uma estratégia preventiva e curativa. Quando o RN tem hemoglobina maior do que 10g/dL, são realizadas trocas com duas volemias.
Comentário: Os objetivos da EST são reduzir os níveis de bilirrubina e o risco de encefalopatia bilirrubínica. Com a técnica, há remoção das hemácias com anticorpos ligados e/ou circulantes, redução da bilirrubina e correção da anemia. O sangue deve estar disponível em 2 a 4 horas após a solicitação da reserva de EST.
Comentário: Na técnica de EST com duas volemias, ocorre substituição de 85 a 90% das hemácias e diminuição de 50% de bilirrubina total e frações.
Comentário: A glicose é o principal substrato energético fetal, apesar de o feto poder lançar mão de outros substratos alternativos no momento de privação de glicose.
Resposta: Os principais eventos induzidos pela hipoglicemia implicados na morte neuronal são ativação dos receptores de glutamato nos neurônios, estresse oxidativo e liberação de radicais livres, liberação neuronal de zinco, além da ativação do PARP1.
Comentário: Estudos de RM mostram que a principal lesão na hipoglicemia é a desmielinização da substância branca.
Comentário: Entre os RNs de risco para hipoglicemia, estão os prematuros, os pequenos para IG, os grandes para IG, os filhos de mãe diabética e os com asfixia, hipotermia, sepse, cardiopatia congênita complexa, doença hemolítica por incompatibilidade Rh, policitemia e hipotermia.
Comentário: O início do tratamento com fototerapia intensiva, na maior superfície corpórea do RN com EBA, deve ser imediato, antes mesmo do resultado de exames laboratoriais. É considerada intensiva a fototerapia com irradiância superior a 30μW/cm2/nm, que pode ser obtida com a utilização de uma fototerapia superior e uma inferior. Logo após a detecção da EBA, assim que o sangue estiver disponível, a EST deve ser realizada.
Comentário: Não existe um valor exato para definir o quadro da EBA. Sabe-se que, nos RNs com 35 semanas ou mais de IG, a EBA é caracterizada por alterações progressivas no estado mental, no comportamento e no tônus muscular, sendo dividida em três fases. Na fase inicial, o RN desenvolve sintomas inespecíficos (letargia, hipotonia e debilidade de sucção), progredindo, em 3 a 5 dias, para a fase intermediária (com estupor, irritabilidade e hipertonia, opistótono e/ou retrocolo). Nesse período, a hipertermia pode ser detectada com choro intenso e irritabilidade. A hipertonia dos músculos extensores é caracterizada por arqueamento cervical (retrocolo) ou do tronco (opistótono). Se não tratada em tempo hábil, evolui para a fase avançada e/ou óbito. Na fase avançada, o dano cerebral é irreversível na maioria dos casos e observam-se choro constante, febre, estupor ou coma, e as convulsões podem ocorrer, com agravamento do opistótono. Nos RNs que sobrevivem à EBA, há melhora aparente, até que, em período variável, aparecem as sequelas neurológicas características da encefalopatia aguda, o kernicterus.
Resposta: O diagnóstico mais provável do paciente é hipoglicemia, por se tratar de um RN grande para IG e filho de mãe diabética insulino-dependente. O diagnóstico diferencial deve ser realizado com hipocalcemia e hipomagnesemia, que também ocorrem no filho de mãe diabética, mas menos frequentemente.
Resposta: A conduta mais indicada para esse caso é a realização da glicemia capilar e, se esta for baixa, realizar confirmação com glicemia plasmática. Em se confirmando a hipoglicemia, a conduta seria a infusão IV de um bolo de glicose seguida de uma infusão contínua de glicose, por se tratar de um RN com hipoglicemia sintomática.
Referências
1. Olusanya BO, Kaplan M, Hansen TWR. Neonatal hyperbilirubinaemia: a global perspective. Lancet Child Adolesc Health. 2018;2:610–20. https://doi.org/10.1016/S2352-4642(18)30139-1
2. Karimzadeh P, Fallahi M, Kazemian M, Taslimi Taleghani N, Nouripour S, Radfar M. Bilirubin induced encephalopathy. Iran J Child Neurol. 2020;14:7–19.
3. Committee on Fetus and Newborn; Adamkin DH. Postnatal glucose homeostasis in late-preterm and term infants. Pediatrics. 2011;127:575–9. https://doi.org/10.1542/peds.2010-3851
4. Iskander I, Gamaleldin R. Acute bilirubin encephalopathy: some lessons learned. Semin Perinatol. 2021;45:151353. https://doi.org/10.1016/j.semperi.2020.151353
5. Donneborg ML, Hansen BM, Vandborg PK, Rodrigo-Domingo M, Ebbesen F. Extreme neonatal hyperbilirubinemia and kernicterus spectrum disorder in Denmark during the years 2000-2015. J Perinatol. 2020;40:194–202. https://doi.org/10.1038/s41372-019-0566-8
6. Brasil. Ministério da Saúde. Mortalidade e Nascidos Vivos: nascidos vivos desde 1994 Brasília: DATASUS, 2020 [acesso em 2021 out 1]. Disponível em: http://tabnet.datasus.gov.br/cgi/deftohtm.exe?sinasc/cnv/nvuf.def.
7. Morioka I, Nakamura H, Koda T, Yokota T, Okada H, Katayama Y, et al. Current incidence of clinical kernicterus in preterm infants in Japan. Pediatrics International. 2015; 57:494–7. https://doi.org/10.1111/ped.12651
8. Draque CM, Almeida MFB. Análise crítica das características da icterícia no recém-nascido pré-termo e seu tratamento. In: Sociedade Brasileira de Pediatria; Procianoy RS, Leone CR, organizadores. PRORN Programa de Atualização em Neonatologia: Ciclo 14. Porto Alegre: Artmed Panamericana; 2017. p. 61–85. (Sistema de Educação Continuada a Distância, v. 2).
9. Riordan SM, Shapiro SM. Review of bilirubin neurotoxicity I: molecular biology and neuropathology of disease. Pediatr Res. 2020;87:327–31. https://doi.org/10.1038/s41390-019-0608-0
10. Zangen S, Kidron D, Gelbart T, Roy-Chowdhury N, Wang X, Kaplan M. Fatal kernicterus in a girl deficient in glucose-6-phosphate dehydrogenase: a paradigm of synergistic heterozygosity. J Pediatr. 2009;154:616–9. https://doi.org/10.1016/j.jpeds.2008.10.049
11. American Academy of Pediatrics. Management of hyperbilirrubinemia in the newborn infant 35 or more weeks of gestation. Pediatrics. 2004;114:297–316. https://doi.org/10.1542/peds.114.1.297
12. Ribeiro BN, Lima GD, Ventura N, Gasparetto EL, Marchiori E. Chronic kernicterus: magnetic resonance imaging findings. Radiol Bras. 2016;49:407–8. https://doi.org/10.1590/0100-3984.2015.0190
13. Hameed NN, Hussein MA. BIND score: a system to triage infants readmitted for extreme hyperbilirubinemia. Semin Perinatol. 2021;45:151354. https://doi.org/10.1016/j.semperi.2020.151354
14. Johnson L, Bhutani VK, Karp K, Sivieri EM, Shapiro SM. Clinical report from the pilot USA kernicterus registry (1992 to 2004). J Perinatol. 2009;29:S25–45. https://doi.org/10.1038/jp.2008.211
15. Meneses J, Brandão DCB. Encefalopatia bilirrubínica - aspectos atuais. PRORN. 2013;10(3):31–53.
16. Barbério GS, Zingra ACG, Santos PSS, Machado MAAM. Green teeth related to bilirubin levels. Acta Stomatol Croat. 2018;52:61–4. https://doi.org/10.15644/asc52/1/9
17. Shapiro SM. Definition of the clinical spectrum of kernicterus and bilirubin-induced neurologic dysfunction (BIND). J Perinatol. 2005;25:54–9. https://doi.org/10.1038/sj.jp.7211157
18. Hansen TW. The role of phototherapy in the crash-cart approach to extreme neonatal jaundice. Semin Perinatol. 2011;35:171–4. https://doi.org/10.1053/j.semperi.2011.02.012
19. Brandão DCB, Portela NM, Almeida MFB. Fototerapia: eficácia, indicações e eventos adversos. In: Sociedade Brasileira de Pediatria; Procianoy RS, Leone CR, organizadores. PRORN Programa de Atualização em Neonatologia: Ciclo 17. Porto Alegre: Artmed Panamericana; 2020. p.49–84. (Sistema de Educação Continuada a Distância, v. 4).
20. Rosen O, Angert R. Exchange transfusion simulation models: a technical report. Cureus. 2019;11:e5317. https://doi.org/10.7759/cureus.5317
21. Kakkar B, Agrawal S, Chowdhry M, Muthukumaravel PJ, Makroo RN, Thakur UK. Exchange transfusion in neonatal hyperbilirubinemia: a single centre experience from Northern India. Transfus Apher Sci. 2019;58:102655.
22. Musacchia G, Hu J, Bhutani VK, Wong RJ, Tong ML, Han S, et al. Frequency-following response among neonates with progressive moderate hyperbilirubinemia. J Perinatol. 2020;40:203-11. https://doi.org/10.1016/j.transci.2019.09.008
23. De Angelis LC, Brigati G, Polleri G, Malova M, Parodi A, Minghetti D, et al. Neonatal hypoglycemia and brain vulnerability. Front Endocrinol. 2021;12:634305. https://doi.org/10.3389/fendo.2021.634305
24. Cornblath M, Hawdon JM, Williams AF, Aynsley-Green A, Ward-Platt MP, Schwartz R. Controversies regarding definition of neonatal hypoglycemia: suggested operational thresholds. Pediatrics. 2000;105:1141–5. https://doi.org/10.1542/peds.105.5.1141
25. Guemes M, Rahman SA, Hussain K. What is a normal blood glucose? Arch Dis Child. 2016;101:569–74. https://doi.org/10.1136/archdischild-2015-308336
26. Wight N, Marinelli KA; Academy of Breastfeeding Medicine. ABM clinical protocol #1: guidelines for blood glucose monitoring and treatment of hypoglycemia in term and late-preterm neonates, revised 2014. Breastfeed Med. 2014;9:173–9. https://doi.org/10.1089/bfm.2014.9986
27. Thornton PS, Stanley CA, Leon DD, Harris D, Haymond MW, Hussain K, et al. Recommendations from the Pediatric Endocrine Society for evaluation and management of persistent hypoglycemia in neonates, infants and children. J Pediatr. 2015;167:238–45. https://doi.org/10.1016/j.jpeds.2015.03.057
28. Hawdon JM. Identification and management of neonatal hypoglycemia in the full-term infant. British Association of Perinatal Medicine Framework for Practice, 2017. J Hum Lact. 2019;35:521–3. https://doi.org/10.1177/0890334419846128
29. Narvey MR, Marks SD. The screening and management of newborn at risk for low blood glucose. Paediatr Child Health. 2019;24:536–54. https://doi.org/10.1093/pch/pxz134
30. Wackernagel D, Gustafsson A, Bonamy AKE, Reims A, Ahlsson F, Elfving M, et al. Swedish national guideline for prevention and treatment of neonatal hypoglycemia in newborn infants with gestational age > 35 weeks. Acta Paediatr. 2020;109:31–44. https://doi.org/10.1111/apa.14955
31. Karimzadeh P, Tabarestani S, Ghofrani M. Hypoglycemia-occipital syndrome: a specific neurologic syndrome following neonatal hypoglycemia. J Child Neurol. 2011;26:152–9. https://doi.org/10.1177/0883073810376245
32. Alkalay AL, Flores-Sarnat L, Sarnat HB, Moser FG, Simmons CF. Brain imaging findings in neonatal hypoglycemia: case report and review of 23 cases. Clin Pediatr. 2005;44:783–90. https://doi.org/10.1177/000992280504400906
33. Burns CM, Rutherford MA, Boardman JP, Cowan FM. Patterns of cerebral injury and neurodevelopmental outcomes after symptomatic neonatal hypoglycemia. Pediatrics. 2008;122:65–74. https://doi.org/10.1542/peds.2007-2822
34. Shah R, Harding J, Brown J, McKinlay C. Neonatal glycaemia and neurodevelopmental outcomes: a systematic review and meta-analysis. Neonatology. 2019;115:116–26. https://doi.org/10.1159/000492859
35. Burakevych N, McKinlay CJD, Harris DL, Alsweiler JM, Harding JE. Factors infuencing glycaemic stability after neonatal hypoglycaemia and relationship to neurodevelopmental outcome. Sci Rep. 2019;9:8132. https://doi.org/10.1038/s41598-019-44609-1
36. Harris DL, Weston PJ, Harding JE. Incidence of neonatal hypoglycemia in babies identified as at risk. J Pediatr. 2012;161:787–91. https://doi.org/10.1016/j.jpeds.2012.05.022
37. Edwards T, Harding JE. Clinical aspects of neonatal hypoglycemia: a mini review. Front. Pediatr. 2021;8:562251. https://doi.org/10.3389/fped.2020.562251.
38. Harris DL, Gamble GD, Weston PJ, Harding JE. What happens to blood glucose concentrations after oral treatment for neonatal hypoglycemia?J Pediatr. 2017;190:136–41. https://doi.org/10.1016 / j.jpeds.2017.06.034
39. Moore ER, Bergman N, Anderson GC, Medley N. Early skin-to-skin contact for mothers and their healthy newborn infants. Cochrane Database Syst Rev. 2016;11:CD003519. https://doi.org/10.1002/14651858.CD003519.pub4
40. LeBlanc S, Haushalter J, Seashore C, Wood KS, Steiner MJ, Sutton AG. A quality-improvement initiative to reduce NICU transfers for neonates at risk for hypoglycemia. Pediatrics. 2018;141:e20171143. https://doi.org/10.1542 / peds.2017-1143
41. Edwards T, Liu G, Hegarty JE, Crowther CA, Alsweiler J, Harding JE. Oral dextrose gel to prevent hypoglycemia in at-risk neonates. Cochrane Database Syst Rev. 2021;5:CD012152. https://doi.org/10.1002/14651858.CD012152.pub3
42. McKinlay CJ, Alsweiler JM, Ansell JM, Anstice NS, Chase JG, Gamble GD, et al. Neonatal glycemia and neurodevelopmental outcomes at 2 years. N Engl J Med. 2015;373:1507–18. https://doi.org/10.1056/NEJMoa1504909
Como citar a versão impressa deste documento
Draque CM, Brandão DCB. Encefalopatias metabólicas no período neonatal: bilirrubina e hipoglicemia. In: Sociedade Brasileira de Pediatria; Procianoy RS, Leone CR, organizadores. PRORN Programa de Atualização em Neonatologia: Ciclo 19. Porto Alegre: Artmed Panamericana; 2021. p. 127–60. (Sistema de Educação Continuada a Distância, v. 1). https://doi.org/10.5935/978-65-5848-391-5.C0003